سمعت عن مشروع قانون تنظيم البحوث الطبية الإكلينيكية المعروف بـ"التجارب السريرية"؟؟ .... طب تعرفوا تأثير على العلميين؟؟ عموما فريق موقع « علومنجى دوت كوم » هيوضح كل ما يخص القانون.
تساؤلات بشأن القانون
مَن المسئول عن هذا القانون وتنفيذ بنوده ، خصوصاً إعطاء التصريح والتحويل إلى جهات التحقيق لتوقيع العقوبات ، هل هى وزارة الصحة أم وزارة البحث العلمى والتعليم العالى أم وزارة العدل؟
وما دخل الجهات الدينية فى موضوع البحث حيث تنص قوانين الدولة على عدم المشاركة فى أبحاث تتعارض مع القيم الدينية؟
ما هو مصطلح باستخدام المرضى المصريين «كفئران تجارب»؟
مين هو الباحث الرئيسى واللى ترك مبهم فى القانون دون توضيح؟
التجارب الإكلينيكية «البحوث التي تجري على المبحوثين من البشر» هتبقى مقتصرة على مين تبعا للقانون ؟
هل هناك ضرورة لتجربة الأدوية الجديدة على الإنسان؟ وهل هناك ضرورة لتجربة الدواء على عدد من البلاد تشمل البلاد المتقدمة والبلاد النامية والبلاد التى تعيش تحت ظروف اقتصادية واجتماعية ومناخية مختلفة؟
هل يمكن لدواء جديد يُطرح دون تجربته على الإنسان ودراسة آثاره الجانبية ، فضلاً عن دراسة ديناميكية هذا الدواء الحيوية من ناحية الامتصاص والنسبة فى الدم ، وفترة العمل وطريقة الجسم فى التخلص من الدواء عن طريق البول أو الكبد أو الجهاز الهضمى؟
هل القانون الجديد هيضع اشتراطات مشابهه لأشتراطات FDA الأمريكية ، أو لجنة الدواء فى إنجلترا وفى السويد ؟
لماذا تحتاج شركات الدواء لتجربة أدويتها فى بلادنا إذا كان هذا ممكناً ومطلوباً فى بلادها؟
أن النقابة (العلميين) هى اللاعب الأول والرئيسى فى هذا الموضوع ، وهى الأساسية بل والأكثر مشاركة بين جميع الهيئات التى أثارت هذا الموضوع ، وكان يجب أن يمر القانون عن طريق نقابة العلميين أولاً .
نقابة الاطباء الموقرة :
ونقلاً عن الأستاذ الدكتور محمد أبوالغار (أستاذ أمراض النساء يجامعة القاهرة) والأستاذ الدكتور (محمد غنيم أستاذ جراحة الكلى بجامعة المنصورة) عاوزين يعملوا أبحاث سريرية على الأدوية بكليات الطب والمعاهد التعليمية ، لا وكمان عاوزين اللى يغلط يتحاسب قدام النقابة يعنى اللى ينتهك حياة مواطن مصرى يتحاسب قدام النقابة (يعنى كأنك بتخلى أبو الولد يحاسبة - يعنى يبقى حاميها حرميها) .
أخر الأحداث بشأن القانون
مجلس النواب (البرلمان) يوافق على التعديلات النهائية لمشروع قانون تنظيم البحوث الطبية الإكلينيكية وذلك يوم الأحد 16 أغسطس 2020.
أخر التعديلات على القانون قبل الموافقه:
المادة الثانية من مواد الإصدار:
يُصدر رئيس مجلس الوزراء اللائحة التنفيذية للقانون المرافق خلال ثلاثة أشهر من تاريخ العمل به.
(المادة الثالثة) من مواد الإصدار [مضافة]
بمراعاة أحكام المادة الثانية من مواد إصدار القانون رقم (151) لسنة 2019 بإصدار قانون إنشاء الهيئة المصرية للشراء الموحد والإمداد والتموين الطبى وإدارة التكنولوجيا الطبية وهيئة الدواء المصرية، تباشر الهيئة القومية للرقابة والبحوث الدوائية، والهيئة القومية للبحوث والرقابة على المستحضرات الحيوية، وغيرها من الجهات والكيانات الإدارية ذات الاختصاص بمجال الرقابة على المستحضرات والمستلزمات الطبية، كل فيما يخصه ذات اختصاصات هيئة الدواء المصرية المنصوص عليها فى القانون المرافق، وذلك لحين أن تبدأ هيئة الدواء المصرية فى مباشرة عملها، وفقًا لقانون إنشائها المشار إليها عاليه.
وتم التعديل فى المادة (1) ، الخاصة بالتعريفات ، ووافق المجلس على التعديلات كما هى، وتتمثل فى البنود التالية:
7- المخطط البحثى (البروتوكول): الوثيقة التى تتضمن شرحًا تفصيلياً لخطة إجراء البحث الطبى والمعلومات ذات الصلة به التى تمت مراجعتها والموافقة عليها طبقًا للإجراءات المنصوص عليها فى هذا القانون.
18 - الجهة البحثية: الجهة التى يُجرى فيها البحث الطبى، والمسجلة بالمجلس الأعلى، وفقًا لما تبينه اللائحة التنفيذية لهذا القانون.
19- راعى البحث: من يتولى مسئولية بدء وإدارة وتمويل البحث الطبى والإشراف عليه، سواء كان شخصاً طبيعياً كالباحث الرئيس، أو شخصاً اعتبارياً كشركة أو مؤسسة أو منظمة محلية أو إقليمية أو دولية، شرط أن تكون ممثلة قانوناً داخل جمهورية مصر العربية.
20- منظمات البحوث الطبية التعاقدية: الأشخاص الاعتبارية التى تتخذ شكل منظمة أو مكتب أو شركة وتكون مسجلة بالمجلس الأعلى، والمرخص لها بمتابعة البحوث الطبية، والتى يتعاقد معها راعى الدراسة لأداء أى من واجبات أو مهام البحث الطبى المنوطة به، كما تكون خاضعة فى أعمالها فى هذا الشأن دورياً لمراقبة المجلس الأعلى.
مادة (4)
يتعين قبل البدء فى إجراء أى بحوث طبية وجود بروتوكول تمت مراجعته والموافقة عليه من اللجنة المؤسسية المختصة، على أن تكون موافقتها نهائية في غير البحوث الطبية الإكلينيكية المشار إليها في الفقرة التالية.
ويلزم موافقة هيئة الدواء المصرية، وموافقة واعتماد المجلس الأعلى في حال البحوث الطبية الإكلينيكية التي تشمل استخدام مركبات دوائية مستحدثة أو بيولوجية أو دواعي استعمال جديدة أو أشكال أو مستلزمات أو أجهزة طبية لم تستخدم في جسم الإنسان من قبل، ولم تحصل على اعتماد الجهات الدولية، مثل: منظمة الغذاء والدواء الأمريكية، أو منظمة الطب الأوربية، على أن تجرب في دول مرجعية في ذات الوقت.
ويلزم استطلاع رأي جهاز المخابرات العامة في حال البحوث التي تجرى مع جهات أجنبية والدراسات العالمية المشتركة.
ويتعين إنهاء كافة الإجراءات والرد في غضون ستين يوما من تاريخ الإبلاغ، فإذا لم يتم الرد خلال هذه المدة تعد موافقة.
وذلك كله على النحو المبين بأحكام هذا القانون والإجراءات التى تحددها اللائحة التنفيذية لهذا القانون.
وأضاف المجلس فى هذه المادة عبارة "يلزم استطلاع رأى الجهات الرقابية الدوائية، وفى الفقرة قبل الأخيرة وضع عبارة أن يكون الرد فى غضون ستين يوما بدلا من "تسعين يوما"، وذلك بناء على طلب الحكومة ممثلة فى المستشار علاء فؤاد، وزير شئون المجالس النيابية.
ولم تحصل على اعتماد الجهات الدوائية التى تحددها.
مادة (5) حذفت المادة لدمج حكمها مع المادة (4) وأعيد ترتيب مواد المشروع.
الفصل الثالث
المجلس الأعلى لمراجعة أخلاقيات البحوث الطبية الإكلينيكية
ــــــــــ
مادة (7) أضحت مادة (6)
يُنشأ مجلس أعلى لمراجعة أخلاقيات البحوث الطبية الإكلينيكية، يتمتع بالشخصية الاعتبارية، يتبع رئيس مجلس الوزراء ويصدر بتشكيله قرار منه، وذلك على النحو الآتى:
1- ثلاثة من أعضاء هيئات التدريس بالجامعات يختارهم الوزير المختص بالتعليم العالى.
2- اثنان من الأساتذة الباحثين بالمراكز والمعاهد والهيئات البحثية ذات الصلة بعمل المجلس الأعلى يختارهما الوزير المختص بالبحث العلمى.
3- ممثلان اثنان عن وزارة الصحة والسكان يختارهما الوزير المختص بالصحة.
4- ممثل عن هيئة الدواء المصرية يختاره رئيس مجلس الوزراء.
5- ممثل عن وزارة الدفاع يختاره وزير الدفاع.
6- ممثل عن وزارة الداخلية يختاره وزير الداخلية.
7- ممثل عن جهاز المخابرات العامة يختاره رئيس الجهاز.
8- أحد نواب رئيس مجلس الدولة يختاره رئيس المجلس.
9- أحد الشخصيات العامة من ذوى الخبرة يختاره الوزير المختص بالتعليم العالى .
10- أحد الشخصيات العامة من ذوى الخبرة يختاره الوزير المختص بالبحث العلمى .
11- أحد الشخصيات العامة من ذوى الخبرة يختاره الوزير المختص بالصحة.
وتكون مدة المجلس أربع سنوات قابلة للتجديد مرة واحدة.
على أن يحدد بالقرار الصادر بالتشكيل رئيس المجلس من بين أعضائه.
ويتولى رئيس المجلس تمثيله أمام القضاء وفى صلاته بالغير.
وللمجلس أن يستعين بمن يراه عند الاقتضاء لحضور جلساته دون أن يكون له صوت معدود، وله أن يشكل لجاناً من بين أعضائه أو من غيرهم لتنفيذ أى من اختصاصاته.
ويحدد بقرار تشكيل المجلس، مقر عمله والمعاملة المالية لرئيس المجلس وأعضائه.
ويكون للمجلس الأعلى أمانة عامة تتولى القيام بما يكلفها به من مهام، ويرأسها أمين عام يتفرغ لعمله، ويصدر بتشكيل الأمانة وتحديد من يتولى منصب الأمين العام، ونظام عملها، ومكافآت الأمين العام والعاملين بها قرارًا من رئيس مجلس الوزراء.
مادة (8) أضحت مادة (7)
يباشر المجلس الأعلى اختصاصاته على الوجه المبين بهذا القانون، وله على الأخص ما يأتى:
1- إنشاء قاعدة بيانات خاصة بالبحوث الطبية تشتمل على بروتوكولات البحوث وكافة الوثائق والبيانات والمعلومات المتعلقة بها والتعديلات التي وردت عليها.
2- وضع المعايير والضوابط واللوائح الخاصة بأخلاقيات البحوث الطبية لحماية الإنسان وعيناته وبياناته، ومراجعتها وفق ما تقتضيه المصلحة الوطنية والمستجدات العلمية الدولية.
3- المراجعة النهائية للمخططات البحثية (البروتوكولات) التي تشمل استخدام مركبات دوائية مستحدثة أو بيولوجية أو دواعي استعمال جديدة أو أشكال أو مستلزمات أو أجهزة طبية لم تستخدم في جسم الإنسان من قبل ولم تحصل على اعتماد الجهات الدولية، مثل: منظمة الغذاء والدواء الأمريكية ، ومنظمة الطب الأوربية، الواردة من اللجان المؤسسية المختصة، وتسجيل واعتماد موافقات هذه اللجان عليها ومراجعة التعديلات التي ترد على هذه المخططات البحثية، وإصدار القرار النهائي لأي منها، بالموافقة على هذه المخططات والتعديلات التي ترد عليها أو رفضها، وكذلك استطلاع رأى جهاز المخابرات العامة في حال البحوث التي تجرى مع جهات أجنبية والدراسات العالمية المشتركة.
4- المراجعة الدورية والتفتيش على الجهات البحثية التى تُجرى فيها البحوث الطبية الإكلينيكية والجهات ذات الصلة بتلك البحوث للتأكد من تطبيق معايير الممارسة الطبية الجيدة المتعارف عليها محلياً ودولياً، وفقاً لطبيعة المخاطر التى يمكن أن يتعرض لها المبحوث.
5- فحص الشكاوى التى ترد من الأفراد أو الجهات ذات الصلة إلى المجلس بشأن الأبحاث الطبية الإكلينيكية، والبت فيها.
6- إصدار قرار مسبب بتعليق البحث الطبى لمدة لا تجاوز سنة، أو رفض تجديده، أو إنهائه مبكراً وذلك حال عدم الالتزام ببنود المخطط البحثى (البروتوكول) أو التعديلات التى وردت عليه، أو إذا ترتبت عليه آثار جانبية أو آثار جانبية خطيرة أو أى أضرار لم تكن متوقعة وقت الموافقة على المخطط البحثى، مع منع الباحث الرئيس أو الجهة البحثية التى يجرى بها البحث الطبى من إجراء بحوث طبية مستقبلية لمدة لا تجاوز سنتين، وذلك كله على النحو الذى تبينه اللائحة التنفيذية لهذا القانون.
الفصل الرابع
اللجان المؤسسية لمراجعة أخلاقيات البحوث
الطبية الإكلينيكية وهيئة الدواء المصرية
ـــــــــــ
أولاً: اللجان المؤسسية لمراجعة أخلاقيات البحوث الطبية الإكلينيكية
مادة (9) أضحت مادة (8)
تُشكل داخل كل جهة بحثية بقرار من السلطة المختصة بهذه الجهة لجنة تسمى (اللجنة المؤسسية لمراجعة أخلاقيات البحوث الطبية)، ويُشترط أن تكون هذه اللجنة مسجلة بالمجلس الأعلى.
وتختص هذه اللجنة بما يأتى:
1- رعاية حقوق المبحوثين وأمانهم وصحتهم.
2- مراجعة المخططات البحثية (البروتوكولات) التى تُقدم إليها، والتأكد من استيفائها لجميع الأوراق والموافقات والمستندات اللازمة فى هذا الشأن بحسب كل حالة.
3- إصدار قرار بالموافقة على إجراء البحث الطبى أو تجديده، وتحديد مدته بما لا يجاوز سنة، ومتابعته حتى إنهائه أو انتهائه.
4- مراقبة الباحث الرئيس وراعى البحث- إن وُجد- لضمان تنفيذ البحث الطبى على الوجه الصحيح، وتطبيق معايير الممارسة الطبية الجيدة.
على أن تلتزم اللجنة المؤسسية بإخطار المجلس الأعلى بكافة البحوث المقدمة إليها، على أن يشتمل الإخطار على بروتوكول البحث الطبى وجميع الوثائق والبيانات المتعلقة به، وكذا كافة الإجراءات التى اتخذتها اللجنة فى هذا الشأن.
مادة (10) أضحت مادة (9)
تختص هيئة الدواء المصرية، بالإضافة إلى اختصاصاتها المنصوص عليها فى القانون رقم 151 لسنة 2019، بممارسة الاختصاصات الآتية:
أ- تقييم نتائج البحوث الطبية ما قبل الإكلينيكية والإكلينيكية.
ب- المراجعة العلمية للمستحضر الدوائى أو البيولوجى، وذلك قبل البدء فى إجراء البحوث الطبية الإكلينيكية .
ج- تقييم المخطط البحثى والتعديلات التى ترد عليه، ومراجعة المستندات الخاصة بالمستحضر محل البحث الطبى وذلك بقصد التأكد من تحقيق الممارسة الطبية الجيدة للتصنيع والتداول والحفظ.
د- التفتيش على الجهات البحثية التى يجرى بها البحث الطبي الإكلينيكى والجهات ذات الصلة، بغرض التحقق من الممارسة الطبية الجيدة.
ويحصل لصالح هيئة الدواء المصرية مقابل خدمة نظير نشاطاتها المشار إليها بالبنود السابقة بما لا يجاوز الحد الأقصى للرسوم الواردة بالجدول الملحق بقانون الهيئة، ويصدر بتحديد فئات هذا المقابل قرار من رئيس مجلس الوزراء.
وتحدد اللائحة التنفيذية لهذا القانون، الإجراءات التى تكفل قيام هيئة الدواء المصرية بممارسة هذه الاختصاصات، والتنسيق بينها وبين كل من اللجان المؤسسية المختصة والمجلس الأعلى فى هذا الشأن.
مراحل الأبحاث الطبية الإكلينيكية :
مادة (11) أضحت مادة (10)
يتعين أن تسبق البحوث الطبية الإكلينيكية، بحوث طبية ما قبل إكلينيكية، تمت مراجعتها علميًّا وتمت الموافقة عليها كتابة من هيئة الدواء المصرية.
إضافة الفقرتين التاليتين:
"ويسمح بإجراء جميع المراحل المشار إليها بشرط مراجعة نتائج كل مرحلة والسماح بالانتقال إلى المرحلة التالية بعد موافقة هيئة الدواء المصرية.
أما التدخلات الطبية التى تنشأ خارج جمهورية مصر العربية، فيُسمح فيها بإجراء المرحلتين الثالثة والرابعة، بعد مراجعة واعتماد نتائج المرحلتين الأولى والثانية اللتين تم إجراؤهما فى بلد المنشأ من هيئة الدواء المصرية والمجلس الأعلى.
وتم إضافة فقرة للمادة (23) نصها كالتالى:
ويلزم موافقة المجلس الأعلى، وكذلك مراعاة اعتبارات ومقتضيات الأمن القومى، قبل دخول أو خروج أى عينات بشرية تخص البحوث الطبية من وإلى جمهورية مصر العربية، لأى غرض.
مادة (27) أضحت مادة 26
يعاقب بالحبس كل من أجرى بحثاً طبياً إكلينيكياً دون الحصول على الموافقة المستنيرة من المبحوث ومن الممثل القانونى عن الفئات المستحقة حماية إضافية من المبحوثين وموافقات الجهات المحددة بهذا القانون.
فإذا ترتب على ذلك حدوث عاهة مستديمة، تكون العقوبة السجن المشدد من ثلاث إلى عشر سنوات ، وتكون العقوبة السجن المشدد أو السجن الذى لا تقل مدته عن عشر سنين إذا ترتب على الفعل المشار إليه موت شخص أو أكثر.
مادة (28) أضحت مادة (27)
يعاقب بالحبس وبغرامة لا تقل عن خمسين ألف جنيه ولا تزيد عن خسمائة ألف جنيه ، كل من الباحث الرئيس وراعى الدراسة حال عدم الالتزام بأى حكم من أحكام المادتين (18، 20) من هذا القانون
مادة (31) أضحت مادة (30)
يعاقب بالحبس وبغرامة لا تقل عن خمسمائة ألف جنيه ولا تزيد على مليون جنيه، أو بإحدى هاتين العقوبتين، كل من ساهم بأى صورة كانت فى خروج عينات بشرية تستخدم فى الأبحاث الطبية الإكلينيكية أثناء إجرائها أو بعد انتهائها دون الحصول مسبقاً على الموافقات المتطلبة وفقاً لأحكام القانون.
مادة (33) أضحت مادة (32)
يكون للقائمين على تنفيذ هذا القانون والقرارات المنفذة له الذين يصدر بتحديدهم قرار من وزير العدل بالاتفاق مع الوزير المختص بالصحة صفة مأمورى الضبط القضائى بالنسبة للجرائم التى تقع بالمخالفة لأحكام هذا القانون
تعريف قانون البحوث الطبية الإكلينيكية
المفروض ان دا قانون بينظم العلاقة بين الباحث والمؤسسة التى سيتم إجراء البحث معهم والمبحوثين (الذى سيتم إجراء البحث عليهم) ، بالإضافة إلى حماية كل تلك الأطراف و يتعلق القانون بقضية جوهرية تمس المرضى ومستقبل التجارب الطبية وصناعة الدواء ويتضمن القانون إنشاء «مجلس أعلى لأخلاقيات البحوث الطبية» وسيُمثل به جميع أطياف الدولة بالإضافة إلى وضع سقف زمنى يصل إلى 90 - 120 يوما للحصول على موافقة الدولة لإجراء تلك البحوث بعد أن كانت تعوق الباحثين حيث كانت تصل إلى أكثر من عام.
بص يا حاج وبصى يا حاجة انا هاتكلم معاكم بصراحة أتمنى أنها تنظف صدا التعليم المجاني وسوق خزعبلات الأطباء ، لما توافق بلدك على القانون دا فحضرتك لما نيجي نجرب عليك حاجة فأنت هاتبقى فار تجارب حرفياً ، وسيبك من أي مسميات أطباء السبوبة بيحاولوا يحطوها علشان يمنعوا اصحاب الحقوق كعادتهم.
فكرة عامة عن القانون
نتكلم عن التجارب العلمية على الانسان و القانون بتاعه في مصر:
اولا: ارفض تسميتها قانون التجريب الطبي او التجارب الطبية لان التجريب بتاع العلميين والانسان مادة دراسة بتاعتنا.بص يا حاج وبصى يا حاجة انا هاتكلم معاكم بصراحة أتمنى أنها تنظف صدا التعليم المجاني وسوق خزعبلات الأطباء ، لما توافق بلدك على القانون دا فحضرتك لما نيجي نجرب عليك حاجة فأنت هاتبقى فار تجارب حرفياً ، وسيبك من أي مسميات أطباء السبوبة بيحاولوا يحطوها علشان يمنعوا اصحاب الحقوق كعادتهم.
ثانيا: نبص في تاثير القانون دا على العلماء اللي فعلا بيعملوا كل شيء والقانون بيسلبهم حقوقهم لصالح الطبيب او الصيدلي اللي اصلا كل دوره بس المفروض المراقبه ودا مكتوب داخل القانون بس القانون فيه مبالغة في دورهم بشكل كبير جدا ومش زي ما باقي الدول بتعمل هما موظفين مش اكثر وبنشكرهم على ادؤهم لوظيفتهم في اخر البحث.
كونك فار تجارب دا شيء مش وحش وكون في قانون للتجارب العلمية على أهم حيوان اللي هو الإنسان فدا غاية ما نقوم به في معاملنا علشان نقضي على الأمراض والتخلف اللي انتوا عايشينه ، وبكرر الطبيب او الصيدلي راجل مهني بيشتغل شغل فني بالصلاة على النبي ودا ما يقللش منهم بس دا عملهم الاساسي ، لكن اللي بيتعلم علم ويشتغل فيه دا ارتفع من مرتبة المهنة لكونه عالم ودول مش هاتلاقوهم في مصر كثير بالنسبة للصيادلة وتقريبا مش موجودين في الاطباء أصلا واللي موجود هاتلاقيه بره مصر.
كوارث القانون
أولا لو مفكر انه معمول علشان احنا علماء مصر هانعمل دواء فانت اتنقلت من كونك فار تجارب لشئ آخر بذيل.القانون دا ما فيهوش إشارة لأن ممكن حد "شخص مصري" يسجل بروتوكول لعلاج ، لا كله موجه لتقنين تجارب شركات الأدوية علينا (يعنى هيبقى قانونى).
طب ازاي؟؟
انا كشخص بيشتغل في أبحاث العلوم الأساسية الطبية عملت دواء وقدمت علشان أجربة ، هايبقى انا كعلمي اللي عامل الدواء أو الجهاز ولأنك في مصر هايقولك انا هاحط مشرف طبيب على البحث انا لا يمكن أقرب من شيء زي دا ، طب ليه؟
لان دي سرقة علمية خالصة لو هاتدخل عالم الأجهزة والأدوية لأن الأمور دي ما بتتنشرش علميا بشكل واضح أو مباشر وممكن ما تنشرش إلا بعد نجاحها فتلاقي نفسك قانونا بعد تعب واجتهاد وتفكير وعقبات علمية تخطيتها وتلاقي سيادة الطبيب اللى دوره مراقبة العمليات الحيوية (يعني ما شاركش ولا يفقه من العلم وراء الموضوع أي شيء حتى لو معاه دكتوراة هو بس بيؤدي دوره المهني خلينا فاكرين الطب مهنة والعالم بيتجه نحو التدريب برامج الزمالة والبورد حاجة فوق المستوى المهني) سرق كل مجهودك.طب مين يقدر يدخل؟
الشركات لانها بتكون مسجلة وعندها طرق حماية للمنتج بتاعها ممكن مسجلاه باسمها وطبعا هيكون بالخارج ودي عملية سهلة جدا ما فيهاش تدقيق كبير من ناحية الأثر هو بس الأساس العلمي لو صح وفي نتيجة بيعدي.يعني لو شركة قالت عندنا دواء الإيدز وسجلته باسمها في اي بلد تافهه علشان الطبيب المصري ما يسرقوش ، تقوم ضربة نتايج وتيجي عندك تجرب على المصريين.
الباحث الرئيسى
القانون عرف الباحث الرئيسي انه يكون دارس هما يقصدوا طبعا الأطباء بس الحقيقة هيكونوا أطباء و صيادلة. الأطباء دايما بيغالطوا نفسهم في تهميش العلميين بالرغم من أن العلميين اصلاً هم الأساس والأطباء هيشتغلوا على مخرجات تجاربهم ودايما الطبيب يقولك العلمي ما لوش في الطب والصيدلي يقولك العلمى ملوش فى الصيدلة.
اقسم بالله ما عايزين نشتغل شغلكم اصلا ، الطب والصيدلة يا سادة مهنة "يعنى جزء بسيط من العلم".
العالم أو الكيميائي بيكون في لحظة التجربة أعلم من الطبيب والصيدلي ، لأنه هو اللي صمم وتابع فئران التجارب ، وفي بعض التجارب اللي بيقوم بالخطوات دى علميين فقط ، كمان في نظم بتسمح بتواجد العلميين لمتابعة المريض بل يكاد يكون شرط أيضا فى بعض التجارب ، ايوة اضرب نفسك بالقلم.
العالم أو الكيميائي بيكون في لحظة التجربة أعلم من الطبيب والصيدلي ، لأنه هو اللي صمم وتابع فئران التجارب ، وفي بعض التجارب اللي بيقوم بالخطوات دى علميين فقط ، كمان في نظم بتسمح بتواجد العلميين لمتابعة المريض بل يكاد يكون شرط أيضا فى بعض التجارب ، ايوة اضرب نفسك بالقلم.
اللي عمل دواء السوفالدي كيميائي واتسمى باسمه دا للتقريب انا ممكن افتح عالرابع واجيبلك من اول الاسبرين والهيروين لعند استخدام تطبيقات النانو في تحسين الاثر الصيدلي ومعظم من يعمل في ابحاث و تطوير الدواء علميين.
في اللحظة دي سيادتك انت مادة دراسة ما حدش بيكون عارف انت ايه اللي بيحصلك وأكثر حد بيكون فاهم آلية عمل التجربة هو العلمي اللي صمم و درس قبل كدة و بيكون عنده توقعات و سيناريوهات للي هيحصلك حتى قبل ما يحصل.
طبعا القانون متخلف ويا دوب بيتعامل مع التجارب العلمية على البشر بنظرة فنيين شايفين مستويات التجارب دي 4 و لكن في تجارب انا قلت اللي بيعملها علميين بس زي تجارب الفضاء مثلا (ولة هو فى طب الفضاء) ، قصدي هنا الحاجات اللي احنا ما نعرفهاش الحاجات اللي مش في الكتب لما نحب نروح المريخ مثلا مش هاتلاقي دا في كتب ففي كيميائي وفيزيائي وكيميائي حيوي ومهندس هما اللي هايعملوا كل حاجة.
فرضنا حصل وقدرنا ننتقل في الفضاء بسرعة الضوء كمصريين يعني تجيب واحد فني مش فاهم الجسم هايحصله ايه وتقول اصله بططساية هذه المهنة الفنية.
ما تيجى نعمل اسقاط:
جهاز الكفتة بتاع الجيش للواء الجنرال الطبيب عبد العاطي عرض جهازه على الاطباء وادوله موافقه
ولو عاوز تعرف اكتر عن علم الكفتولوجى من الرابط دا .
المبدأ العلمي للجهاز اصلا غبر مثبت علميا دا ملخص للقانون الحالي ، وطبعا ما يفوتناش اني استنكر موافقة جهاز المخابرات على اجراء الابحاث واحد من اسباب التخلف العلمي في مصر الموافقات الامنية وان كنت ارى ان تمثيل وزارة الدفاع شيء ايجابي ليس بهدف الرقابة وانما يمكن ان تستفيد القوات المسلحة باي بحث ودا في الصالح العام طبعا.
الطبيب أو الصيدلي بيكون مدرب على اللي شافه أو اللي عرفهوله في مهنته لكن ما يعرفش ها يقابله ايه.
ايوة نفض رأسك من التراب اللي فيها ، الطب والصيدلة مهن يعني ناس مدربة بجزء من العلم فني بشهادة جامعية وهنا يبان أهمية كلية العلوم.
لاي حد وخاصة الاطباء والصيادلة من امتى حضراتكم عملتوا دواء او طريقة تشخيص مبنية على اساس علمي؟؟
قبل ما تجاوب وتكلمنى على بره مصر ، سمي 20 دواء او 20 طريقة تشخيص جديدة وتكونوا عملتوا الاساس العلمي بتاعها.
بالنسبة للعالم اه بتشاركوا بس النسبة قد ايه ... تقدر تقولى نوبل في الفيسيولوجي تواجدكم فيها مؤخرا كام ، طب اقولك انا اخر 10 سنوات سيطرة تامة للعلميين و بالنسبة لتاريخ العلوم لو حضرتك بتفكر تفتح كتاب الميكروبيولوجى علشان تقول الطبيب الفلاني اكتشف كذا عيد قراءة الموضوع وهاتلاقيه درس كيمياء 4 سنين فى علوم أصلا وهتلاقي برده الغلبة للعلميين.
بالنسبة للعالم اه بتشاركوا بس النسبة قد ايه ... تقدر تقولى نوبل في الفيسيولوجي تواجدكم فيها مؤخرا كام ، طب اقولك انا اخر 10 سنوات سيطرة تامة للعلميين و بالنسبة لتاريخ العلوم لو حضرتك بتفكر تفتح كتاب الميكروبيولوجى علشان تقول الطبيب الفلاني اكتشف كذا عيد قراءة الموضوع وهاتلاقيه درس كيمياء 4 سنين فى علوم أصلا وهتلاقي برده الغلبة للعلميين.
لفئران التجارب اللي خزعبلات السادة الاطباء بقانونهم الجديد عاوزين يبقوا المسؤول الوحيد عن فحص وبحث ودراسة البشر ودا كلام كذب و تدليس والعلميين لهم تلك الحقوق كاملة ولا ننادي بممارسة مهنة الطب اطلاقا لكن لابد ان نفرق بين المهنة والعلم.
مستقبلك بعد القانون
عايزكم تعرفوا اتعمل فيكم ايه ومستقبلكم معاهم ايه؟
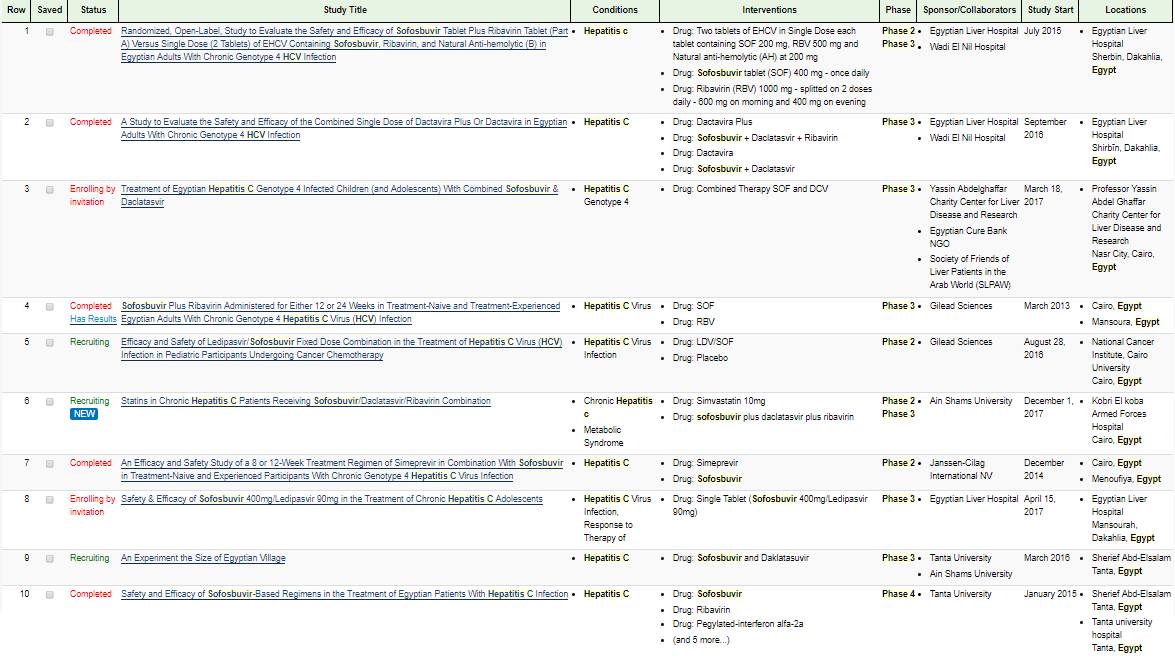
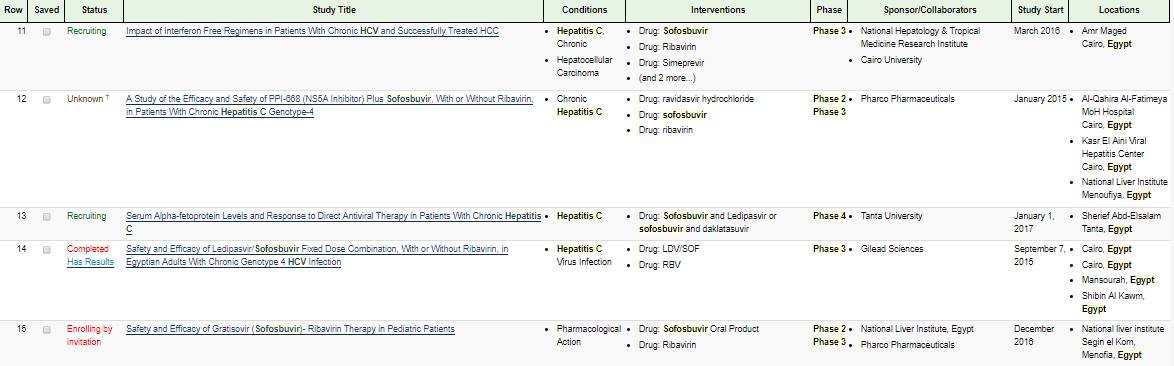
كنت قلت اني هاتكلم عن التجارب اللي الاطباء بيعملوها وبعدين طلع تقرير الـ DW انا كنت ناوي اتكلم عن الدكاترة جمال شيحة و جمال عصمت لاني قرأت ابحاثهم على الانترفيرون بالرغم من وجود تحذيرات في وقته. من غير كلام كثير في موقع بنستخدمه اسمه clinical trials بنشوف الابحاث والتجارب ماشية ازاي تقدر تدخل وتدور على مصر وتشوف الدواء وتطلع نتايج.في 15 بحث عن استحدام السوفوسبوفير في مصر في منها خلص وفي لسه.
في خانة مرحلة العلاج لو لقيت 2 او 3 فالعلاج اتجرب علينا بالمخالفه للقانون حتى لحظة كتابة هذا الموضوع مافيش قانون في مصر للتجريب على البشر والموجود في تجارب الدواء بالقانون لازم يكون مسجل و متداول في بلد المنشأ والدواء يتوافق عليه عندنا لما يبقى في المرحلة 4 ولذلك الناس دي دلوقتى المفروض تتحاكم امام القانون المصري.
خد بالك من خانة المسؤول عن البحث هتلاقيها الشركات اللي بتنتج الادوية ودا مش عيب بس لما يتم بالمخالفة للقانون ففي مشكلة.
شوف بقى الابحاث تمت فين هاتلاقي شبري والمنصورة والقاهرة و قصر القبة وطنطا هما مكتوبين تحت.
تأثير القانون على العلميين
طب القانون هيأثر على العلميين فى أية:
إن البحوث الطبية تنقسم إلى بحوث قبل الإكلينيكية ثم التجارب الإكلينيكية ، حيث أن البحوث ما قبل الإكلينيكية تجري في المعامل على الحيوانات ولا تجري على البشر وإلا نكون قد سمحنا لأنفسنا أن نضع المواطنين مجالا للتجارب وهذا أمر غير مسموح به على الإطلاق ... هم بقى عاوزين يقصروا التجارب الإكلينيكية «البحوث التي تجري على المبحوثين من البشر» على أستاذ جامعي أو طبيب أو صيدلي أو طبيب بيطري ودة منافى ومخالف لكل دول العالم حيث فى كل دول العالم يعمل خريجى كلية العلوم "العلماء" جنبا الى جنب مع الاطباء وغيرهم فى التجارب الاكلينيكية.
مادة تم تعديلها:كان من بين أبرز عيوب مشروع القانون نزع مسؤولية مراكز البحوث عن البحث العلمى والرقابة عليه وتسليمها إلى وزاره الصحة وهذا مخالف للدستور المصرى حيث تذكر مواد القانون أنه سيتم إنشاء لجنة تسجل فى وزارة الصحة داخل منشأة بحثية تسمى (اللجنة المؤسسية لأخلاقيات البحث العلمى) والتى ستختص برعاية حقوق وأمان ومصلحة المبحوثين (الذين سيجرى عليهم البحث) مع مراقبة الباحث الرئيسى وراعى البحث (من يمول البحث العلمى إذا وجد).لكن تم تعديلها وجعل اللجنة المؤسسية لأخلاقيات البحث العلمى تابعه للمجلس الاعلى أى رئاسة الوزراء وليس وزارة الصحة.
من بين أبرز عيوب القانون انه أغفل القانون تمثيل النقابات المهنية «خصوصا العلميين» والمجتمع المدنى وكذلك ممثلون عن المبحوثين لضمان حقوقهم ويجب وضع سقف زمنى مدته شهران وليس أربعة شهور لاعتماد البحث وإعطاء الموافقة.
إن البحوث الطبية تنقسم
إلى بحوث قبل الإكلينيكية ثم التجارب الإكلينيكية»، موضحا أن «البحوث ما
قبل الإكلينيكية تجري في المعامل على الحيوانات ولا تجري على البشر، وإلا
نكون قد سمحنا لأنفسنا أن نضع المواطنين مجالا للتجارب وهذا أمر غير مسموح
به على الإطلاق
للمزيد: https://www.tahrirnews.com/posts/889096/مجلس+النواب+وزير+الصحة+قانون+البحوث+الطبية+الإكلينيكية+البحث+العلمي
للمزيد: https://www.tahrirnews.com/posts/889096/مجلس+النواب+وزير+الصحة+قانون+البحوث+الطبية+الإكلينيكية+البحث+العلمي
إن البحوث الطبية تنقسم
إلى بحوث قبل الإكلينيكية ثم التجارب الإكلينيكية»، موضحا أن «البحوث ما
قبل الإكلينيكية تجري في المعامل على الحيوانات ولا تجري على البشر، وإلا
نكون قد سمحنا لأنفسنا أن نضع المواطنين مجالا للتجارب وهذا أمر غير مسموح
به على الإطلاق
للمزيد: https://www.tahrirnews.com/posts/889096/مجلس+النواب+وزير+الصحة+قانون+البحوث+الطبية+الإكلينيكية+البحث+العلمي
تم الموافقة على مشروع القانون فى الجلسة السابقة ، وسيتم الموافقة النهائية (التصويت الأخير) بالجلسة القادمة فى شهر أغسطس 2020 ، لان وفقاً للمادة 160 من الدستور المصرى التى تنص على أنه لا يجوز إجراء أية تجربة طبية أو علمية عليه بغير رضاه الحر الموثق ولأنه ينظم أحكام خاصة بالجسد الإنسانى وبالتالى الموافقة النهائية عليه تكون بأغلبية ثلثى أعضاء المجلس لذا سيتم إرجاء أخذ الموافقة النهائية فى الجلسة القادمة. للمزيد: https://www.tahrirnews.com/posts/889096/مجلس+النواب+وزير+الصحة+قانون+البحوث+الطبية+الإكلينيكية+البحث+العلمي
دى بعض المعلومات عن نص القانون
رابط القانون
أحدث ما تم بشأن القانون
تشديد الشروط اللازمة لإجراء التجارب الإكلينيكية على الأطفال وذوي الإعاقة والحوامل، من خلال إجراء تعديل على قانون الأبحاث الإكلينيكية، يشترط موافقة الوالدين، قبل إجراء هذه التجارب على "الأطفال وذوي الإعاقة".
أبرز أعتراضات الرئيس السيسي
المواد الخاصة بصلاحيات المجلس الأعلى لأخلاقيات البحوث الطبية، التي جاءت بالمواد "4-5-9-11-20-22"، واشترطت موافقة المجلس الأعلى والجهات القومية والرقابية وجهاز المخابرات العامة على بروتوكول البحث وكذلك التفتيش عليه قبل إجراءه، وهو أمر سيعطل البحث العلمي في مصر في ظل الأعداد الكبيرة للبحوث سنويا سواء الخاصة برسائل الماجستير أو الدكتوارة أو غيرها، وبالتالي يستحيل متابعة كل هذه الأبحاث من خلال المجلس الأعلى إلا من خلال اللجان المؤسسية.
المادة 8 من مشروع القانون، الخاصة بتشكيل المجلس الأعلى للبحوث الطبية الإكلينيكية، حيث تضمن التشكيل طبقا للقانون 4 ممثلين فقط يختارهم وزير التعليم العالي والبحث العلمي من أصل 15 عضوا، على أن يتولى الأمانة العامة للمجلس رئيس الإدارة المركزية للبحوث الطبية بوزارة الصحة، حيث جاءت هذه البنود برغم من أن ما يجري داخل وزارة الصحة من بحث علمي عددا ضئيلا جدا من البحوث التي تجرى سنويا.
وشملت الاعتراضات "المواد العقابية" بمشروع القانون، حيث لم تضع في اعتبارها طبيعة البحث العلمي، على حسب ما جاء بخطاب الرئيس، واعتبرت المخالفات متساوية بجميع البحوث الطبية بعيدا عن نوع البحث، وهو ما يمكن أن يحدث حالة رعب بين البحاثيين سيؤدي إلى الإعراض عن البحث العلمي في مصر.
فضلا عن حظر مشروع القانون إرسال أي عينات بشرية للخارج بدعوى الخوف من استخدام هذه العينات لإجراء بحوث على جينات المصريين، وهو أمر غير واقعي، خصوصا أن هناك 10 ملايين مصري بالخارج، ويمكن بسهولة عمل هذه الأبحاث، وأن إرسال العينات للخارج يمكن أن يكون الغرض منه الاستفادة من أجهزة وإمكانيات غير موجودة داخل مصر.
النص الكامل لمشروع القانون
الفصل الأول "التعريفات"
المــادة (1)
فى تطبيق أحكام هذا القانون، يقصد بالكلمات والعبارات الآتية المعنى المبين قرين كل منها:
1- البحوث ما قبل الإكلينيكية: هي مرحلة تجريبية مبكرة تسبق التجربة على الإنسـان، تهـدف إلـى تحديـــد درجـــات أمـــان وفاعليـــة التـــدخل الطبـــي المـــراد دراســـته وتــتم مـــن خــلال الاختبـــارات المعملية، أو استخدام حيوانات التجـارب ، وذلـك وفق المعايير الدوليـة المقـررة فـي البحـوث مـا قبل الإكلينيكية.
2- البحوث الإكلينيكية: هي الدارسات أو التجارب التي تجرى علـى متطـوعين مـن البشـر لتقيـيم سلامة وكفاءة أي تدخلات علاجية أو دوائية أو جراحية أو غذائيـة وقائيـة أو تشخيصـية وذلك بهــدف التوصــل إلــى اكتشــافات علميــة وقائيــة أو تشخصــية أو علاجيــة للأمراض ، وكـذلك الدراسـات التـي تجـري للتنقيـب فـي البيانـات الطبيـة الخاصـة بـالمتطوعين لاسـتبيان تقييم رجعى لأثر دواء أو سلوك أو تدخل جراحي، وفقا للمعايير الأخلاقية للبحث المتعارف عليها دوليا.
3- الممارسـة الطبيـة الجيـدة: مجموعـة مـن المبـادئ والمعـايير المتعـارف عليهـا دوليا ومحليا التى تطبق فى شـأن تخطـيط وإدارة وتنفيـذ ومراقبـة وتـدقيق وتسـجيل وتحليـل وتقريـر البحـث الطبي بقصد توفير الثقة في تمتع البيانات والنتائج المعلنة للبحث بالمصداقية والدقـة وصـون سلامة المبحوثين المتطوعين وحقوقهم وسرية بياناتهم من أي سوء.
4ـ البحـث الطبـي التـداخلي: دراسـة يـتم إدراج المبحـوث فيهـا لتلقـى تـدخل طبـي، بقصـد تقيـيم آثـار هذا التدخل على النتائج الطبية فيما يتعلق بالفاعلية والمأمونية.
5ـ البحــث الطبــي غيــر التــداخلي: الدراسة التى يـدرج فيهـا المبحـوث لملاحظتـه بقصــد جمــع معلومات عن تدخل طبي معتمد أو معطيات صحية عنه.
6ـ التــدخل البحثــي أو الطبــي: هــو محــور الدراســة الطبيــة الإكلينيكيــة وتشــمل تــدخلات طبيــة كالأدوية، والأجهزة الطبية، واللقاحـات، والإجـراءات التداخليـة بجسـم الإنسـان، وغيـر ذلـك مـن المنتجات التي تكـون مجـالا للاختبار أو متاحـة بالفعـل وقـد يشـمل هـذا التـدخل البحثـي أيضـا وسائل لا تتدخل بجسم الإنسان، مثل عمليات المسوح الصحية، والتعليم والاستبيانات.
7- المخطط البحثي (البروتوكول): الوثيقة التي تتضمن شـرحا تفصيليا لخطة إجراء البحث الطبى والمعلومـــات ذات الصـــلة بـــه التـــي تمـــت مراجعتهـــا والموافقـــة عليهـــا مـــن اللجنـــة المؤسســـية المختصة، والهيئات القومية الرقابيى، "تبعا لنوعيـة البحـث المقـدم "ووافـق عليهـا واعتمـدها المجلس الأعلى.
8- الباحـث: شـخص مؤهـل مـن الأطبـاء أو الصـيادلة أو العلميـين أو الممرضـين أو غيـرهم ممـن يعملون في مجال البحوث الطبية، يتولى داخل إحدى الجهـات البحثيـة تنفيـذ أعمـال المخطـط البحثى طبقا لتعليمات الباحث الرئيسي وتوجيهاته.
9ـ الباحـث الرئيسـي: شـخص مؤهـل فـي مجـال الأبحـاث الطبيـة الإكلينيكيـة مسـئول عـن المخطـط البحثي وتنفيذه، وكذلك تمويله حال عدم توافر راع للبحث الطبي.
10- الباحـث الرئيسـي المسـاعد: شـخص مؤهـل بـذات التأهيـل المتطلـب للباحـث الرئيسـي يختـاره الأخيـر للقيـام بـبعض مهامـه وتحـت إشـرافه، ويحـل مكانـه حـال تغيبـه أو تعـذر اسـتمراره فـي أداء مهامه.
11- الفريـق البحثـي: مجموعـة مـن البـاحثين المـؤهلين ممـن يعملـون فـي مجـال البحـوث الطبيـة يشاركون في أعمال البحث بحكم مؤهلاتهم أو خبراتهم.
12- المبحوث: الشخص الذي يجرى عليه البحث الطبي ويشارك فيه، سواء كان من المرضـى أو مـن الأصـحاء، وسـواء كـان محـل التـدخل الطبـي أو كـان فـي مجموعـة ضـابطة ، وذلـك كلـه شريطة الحصول بداءة على موافقته المستنيرة وفقا لأحكام هذا القانون.
13- المجموعة الضابطة: مجموعة من المبحوثين لا تحصل على التدخل الطبـي محـل الاختبـار بل تحصـل علـى مـا يسمى بمستحضر الغفـل " البلاسـيبو" أو العلاج القياسـي، وذلـك بقصـد المقارنة وقياس تأثير التدخل الجديد.
14ـ الغفل (البلاسـيبوPLACEBO ): مستحضـر خامـل لـيس لـه أي تـأثير علاجـي، ويشـبه تماما من الناحية الشكلية المستحضر محل البحث، ولكنه لا يحتوي على المادة الفَّعالة.
15ـ الفئات المستحقة حماية إضافية: المبحوثـون الأكثـر تـأثرا بـالإكراه أو الاسـتغلال، بسـبب تقييـد إرادتهــم علــى إعطــاء الموافقــة المســتنيرة لانعــدام أو نقــص الأهليــة أو الضــعف الإدراكــي أو الحالة الصحية.
16- الممثل القانوني: من ينوب عن المبحوث من الفئات المسـتحقة حمايـة إضـافية - والموضـحة بالبند السابق- في إعطاء الموافقة المستنيرة على إجراء البحث الطبي.
17- العينات البشرية: وتشمل جميع المواد البيولوجية ذات الأصل البشري، بما في ذلك الأعضاء والأنسجة وسوائل الجسم والأسنان والشعر والأظـافر وغيرهـا، وكـذلك الأنسـجة المسـتحدثة مـن خلايا تم عزلها من جسم الإنسان وأيضـا المـواد المسـتخرجة مـن الأحمــاض النووية والريبوزومات وغيرها.
18- الجهة البحثية: الجهـة التـي جـرى فيهـا البحـث الطبـي والمسـجلة بالوزارة المختصـة بالصـحة، وفقا لما تبينه اللائحة التنفيذية.
19- راعى البحث: من يتولى مسئولية بدء وإدارة وتمويل البحث الطبي والإشراف عليـه سـواء كـان شخصا كالباحث الرئيسي أو شخصا اعتباريا كشـركة أو مؤسسـة أو منظمـة محليـة أو أو إقليمية أو دولية، شرط أن تكون ممثلة قانونا داخل جمهورية مصر العربية.
20- منظمـــات البحــوث الطبيـــة التعاقديـــة: الأشـــخاص الاعتباريـــة (منظمـــة أو مكتـــب أو شـــركة) المسجلة في الـوزارة المختصـة بالصـحة والمـرخص لهـا بمتابعـة البحـوث الطبيـة، والتـي يتعاقـد معهــا راعــي الدراســة لأداء أي مــن واجبات أو مهـام البحــث الطبـي المنوطــة بـه، وتكــون خاضعه في أعمالها في هذا الشأن دوريا لمراقبة الوزارة المختصة بالصحة.
21- الموافقة المستنيرة: التعبير المكتوب المبني على إرادة حرة وطواعية كاملة، الذى يصدر عن الشخص ذى الأهلية ويتضـمن موافقتـه الصـريحة توقيعا وبصـمة على المشاركة فى البحث الطبي الإكلينيكي بعد إعلامـه وتبصـيره بجميـع جوانـب هـذا البحـث، وعلـى الأخـص الآثـار أو الأخطـار المحتملــة التـي قــد تـؤثر علــى قراره بالمشاركة، وتصدر هذه الموافقة من الممثــل القانوني له في الحالات المشار إليها في أحكام هذا القانون.
22- الآثـار الجانبيـة: أي آثـار بسـيطة غير مرغوب فيها طبيا والتى تستجد على المبحـوث أثنـاء استخدام التدخل البحثي عليه.
23- الآثـار الجانبيـة الخطيـرة: هـي الآثـار التـي تستجد علـى المبحـوث بسـبب اسـتخدام التـدخل البحثي عليه، ويترتب عليها إحداث ضرر جسيم به أو تعريض حياته للخطر.
24- اللجنـة المؤسسـية لأخلاقيـات البحـوث الطبيـة: مجموعـة مـن الأشـخاص ذوي التخصصـات الطبيـة وغيــر الطبيــة، تتـولى مراجعـــــة المخططـات البحثيــة "البروتوكولات" وتطبيـق المبــادئ الأخالقيـة الواجـب اتباعهـا فـي هـذا الشـأن، ويكـون مقرهـا الجهـة البحثيـة، ويشترط فى هذه اللجنة أن تكــون مسـجلة بــالوزارة المختصـة بالصـحة ويشـار إليهـا فـي هـذا القـانون باللجنـة المؤسسية.
25ـ المجلس الأعلى لأخلاقيات البحوث الطبية: المجلس الذى يشكل بقرار من رئيس مجلس الوزراء من مجموعة من الأشخاص بتخصصات طبية وغير طبية منوط بهم وضع السياسات العامة لإجراء البحوث الطبية ومتابعة تنفيذها، يكون مقره ديوان وزارة الصحة والسكان، ويشار إليه فى هذا القانون بالمجلس الأعلى.
26- الهيئــات القوميــة الرقابيــة: الهيئــة القوميــة للرقابــة والبحــوث الدوائيــة والهيئــة القوميــة للبحــوث والرقابة على المستحضرات الحيوية.
27- الجهــات المعنيــة: الجهــة المختصـة بـالبحوث والتنميـة الصـحية والجهـة المختصـة بالشـئون الصيدلية بجمهورية مصر العربية كل حسب تخصصه.
28- منـتج التكـافؤ الحيـوي: وهـو المنـتج المشـابه للغايـة للمنـتج المرجعـي المـرخص بـه، مـع بعـض اختلافات طفيفـة فـي المكونـات غيـر الفَّعالـة، ولا توجـد فـروق ذات مغـزى سـريري بينهمـا، مـن حيث الفاعلية والنقاء وأمان الاستخدام.
29- مركـز التكـافؤ الحيـوي: هــو المركــز المــرخص لــه مــن الــوزارة المختصــة بالصــحة بــإجراء الأبحاث المتعلقة بمنتج التكافؤ الحيوي.
الفصل الثانى "أحكام عامة"
المــادة (2)
تهدف أحكام هذا القانون إلى وضع الأسس والمعايير والضوابط اللازمة لإجراء البحوث الطبية الإكلينيكية وحماية المبحوثين، وتتنوع هذه البحوث ما بين وقائية وتشخيصية وعلاجية وغير علاجية.وتكون البحوث المشار إليها فى الفقرة الأولى تدخلية أو غير تدخلية ويشترط فى هذه الأبحاث أن تلتزم بأحكام القوانين والمواثيق واللوائح ذات الصلة على أن تكون متسقة مع المعايير والمبادىء الأخلاقية الدولية المتعارف عليها وذلك كله على النحو الذى تبينه اللائحة التنفيذية.
المــادة (3)
لا يجوز أن يقتصر إجراء البحث الطبى على مجموعة معينة من البشر أو على الفئات المستحقة حماية إضافية، إلا إذا كان البحث ضرورى ويتعلق بأمراض خاصة بهم ومع توافر المبررات العلمية والأخلاقية للاستعانة بهم وبشرط الحصول على الموافقة المستنيرة من كل منهم أو من الممثل القانونى وذلك كله وفقا للضوابط والإجراءات التى تحددها اللائحة التنفيذية.وفى هذه المادة وافق المجلس على اقتراح النائب محمد السويدى رئيس اتئلاف دعم مصر "الأغلبية البرلمانية"، بشأن شروط إجراء بحوث طبية على الأطفال ، وبحسب الاقتراح يشترط القانون موافقة الوالدين حال إجراء بحث طبى على أى من الأطفال الطبيعيين أو ذوى الإعاقة بجانب الاشتراطات الأخرى بدلا من اشتراط موافقة أحدهما فقط وذلك بهدف زيادة حماية هذه الفئات.
المــادة (4)
يتعين قبل البدء فى أية بحوث طبية وجود بروتوكول تمت مراجعته والموافقة عليه من اللجنة المؤسسية المختصة، وكذا موافقة الهيئات القومية الرقابية ـ كل فيما يخصه تبعا لنوعية البحث المقدم ـ واعتماده من المجلس الأعلى، وذلك كله على النحو المبين بأحكام القانون ولائحته التنفيذية.المــادة (5)
يرسل المجلس الأعلى الأبحاث الطبية الإكلينيكية قبل موافقته النهائية عليها واعتمادها وذلك إلى الجهة المعنية بالأمن القومى لاستطلاع الرأى بغرض الحفاظ على الأمن القومى وفقا للإجراءات والضوابط التى تبينها اللائحة التنفيذية.المــادة (6)
يناط بالمجلس الأعلى متابعة تنفيذ أحكام هذا القانون واتخاذ الإجراءات اللازمة حيال مخالفة أى من أحكامه، وإبلاغ جهات التحقيق المختصة بهذه المخالفات فور اتصال علمه بوقوعها.المــادة (7)
تختص الجهات المعنية واللجان المؤسسية والجهات البحثية ومراكز التكافؤ الحيوي ومنظمات البحوث الطبية التعاقدية- كل فيما يخصه- بالتسجيل والمتابعة والتفتيش الميداني على البحوث الطبية مناط تطبيق أحكام هذا القانون وذلك كله على النحو الذي تحدده اللائحة التنفيذية.المــادة (8)
ينشأ مجلس أعلى للبحوث الطبية الإكلينيكية يتمتع بالشخصية الاعتبارية ويصدر بتشكيله قرار من رئيس مجلس الوزراء وتكون تبعيته لمجلس الوزراء، وذلك على النحو الآتى:1ـ ثلاثة ممثلين عن وزارة الصحة والسكان يختارهم الوزير المختص بالصحة.
2ـ ثلاثة من أعضاء هيئة التدريس بالجامعات يختارهم الوزير المختص بالتعليم العالى.
3ـ واحد من الأساتذة الباحثين بالمراكز والمعاهد والهيئات البحثية ذات الصلة بعمل المجلس الأعلى يختارهم الوزير المختص بالبحث العلمى.
4ـ ممثل عن وزارة الدفاع يختاره وزير الدفاع.
5ـ ممثل عن وزارة الداخلية يختاره وزير الداخلية.
6ـ ممثل عن جهاز المخابرات العامة يختاره رئيس الجهاز.
7ـ أحد نواب رئيس مجلس الدولة يختاره رئيس المجلس.
8ـ اثنين من الشخصيات العامة ذوى الخبرة يختارهما الوزير المختص بالصحة.
9ـ أحد الشخصيات العامة من ذوى الخبرات يختاره الوزير المختص بالتعليم العالى.
10ـ أحد الشخصيات العامة من ذوى الخبرة يختاره الوزير المختص بالبحث العلمى.
وتكون مدة المجلس ثلاث سنوات قابلة للتجديد مرة واحدة، وعلى أن يحدد بالقرار الصادر بالتشكيل، تسمية رئيس المجلس الذى يكون من بين أعضائه، ويتولى رئيس المجلس تمثيله أمام القضاء وفى صلاته بالغير، وللمجلس أن يستعين بمن يراه عند الاقتضاء لحضور جلساته دون أن يكون له صوت معدود، وله أن يشكل لجانا من بين أعضائه أو من غيرهم لتنفيذ أى من اختصاصاته، ويتولى الأمانة العامة للمجلس رئيس الإدارة المركزية للبحوث الطبية بوزارة الصحة، ويحدد بقرار التشكيل، المعاملة المالية للرئيس والأعضاء والأمين العام، وكذا تشكيل الجهاز الإدارى المعاون ومعاملته المالية.
المــادة (9)
يباشر المجلس الأعلى اختصاصاته على الوجه المبين بهذا القانون، وله على الأخص ما يأتي:1- إعداد المعايير والضوابط واللوائح الخاصة بأخلاقيات البحوث الطبية لحماية الإنسان وعيناته وبياناته ومراجعتها وفق ما تقتضيه المصلحة الوطنية والمستجدات العلمية الدولية.
2- المراجعة النهائية للمخططات البحثية (البروتكولات) الواردة من اللجان المؤسسية المختصة وتسجيل واعتماد موافقات هذه اللجان عليها ومراجعة التعديلات التي ترد على هذه المخططات البحثية، وإصدار القرار النهائي لأي منها، بالموافقة على هذه المخططات والتعديلات التي ترد عليها أو رفضها، وذلك بعد استطلاع رأى جهاز المخابرات العامة بما يتسق واعتبارات ومقتضيات الأمن القومي.
3- المراجعة الدورية والتفتيش على الجهات البحثية التي تجرى بها البحوث الطبية والجهات ذات الصلة بتلك البحوث، للتأكد من تطبيق معايير الممارسة الطبية الجيدة المتعارف عليها محليا ودوليا وفقا لطبيعة المخاطر التى يمكن أن يتعرض لها المبحوث.
4- فحص الشكاوى التي ترد من الأفراد أو الجهات ذات الصلة، إلى المجلس بشأن الأبحاث الطبية الإكلينيكية والبت فيها.
5- إصدار قرار مسبب بتعليق البحث الطبي لمدة لا تجاوز سنة أو رفض تجديده أو إنهائه مبكرا حال عدم الالتزام ببنود المخطط البحثى (البروتوكول) أو التعديلات التى وردت عليه أو إذا ترتب عليه آثار جانبية أو آثار جانبية خطيرة أو أية أضرار لم تكن متوقعة وقت الموافقة على المخطط البحثي، مع منع الباحث الرئيسي أو الجهة البحثية التي يجرى بها البحث الطبي من إجراء بحوث طبية مستقبلية لمدة لا تجاوز سنتين، وذلك كله على النحو الذي تبينه اللائحة التنفيذية.
يُحصّل لصالح المجلس الأعلى مقابل خدمة مراجعة الأبحاث الطبية الإكلينيكية بقيمة خمسين ألف جنيه للبحث الممول، ويجوز بقرار من رئيس مجلس الوزراء زيادة هذا المقابل بما لا يجاوز 250 ألف جنيه وفقاً لطبيعة البحث، ويُحصّل هذا المقابل بإيداعه خزينة الجهة الإدارية بموجب إيصال، على أن يودع فى بند مستقل بحساب وزارة الصحة لدى حساب الخزانة العامة الموحد، ويصدر بتحديد فئات هذ المقابل قرار من رئيس الوزراء، وذلك كله على النحو الذى تبينه اللائحة التنفيذية.
الفصل الرابع "اللجان المؤسسية لأخلاقيات البحوث الطبية الإكلينيكية والهيئات القومية الرقابية"
المــادة (10)
تشكل داخل كل جهة بحثية بقرار من السلطة المختصة بهذه الجهة لجنة تسمى "اللجنة المؤسسية لأخلاقيات البحوث الطبية الإكلينيكية"، ويشترط أن تكون هذه اللجنة مسجلة لدى الوزارة المختصة بشئون الصحة، وتختص هذه اللجنة بما يأتى:1ـ رعاية حقوق وأمان ومصلحة المبحوثين.
2ـ المراجعة الأولية للمخططات البحثية (البروتوكولات) التى تقدم إليها والتأكد من استيفائها لجميع الأوراق والموافقات والمستندات اللازمة فى هذا الشأن بحسب كل حالة.
3ـ إصدار قرار بالموافقة الأولية على إجراء البحث الطبى أو تجديده، وتحديد مدته بما لا يجاوز سنة ومتابعته حتى انتهائه.
4ـ مراقبة الباحث الرئيسى وراعى الباحث – إن وجد – لضمان تنفيذ البحث العلمى على الوجه الصحيح، وتطبيق معايير الممارسة الطبية الجيدة، وذلك كله النحو الذى تبينه اللائحة التنفيذية.
المــادة (11)
تختص الهيئات القومية الرقابية، بالإضافة إلى اختصاصاتها المنصوص عليها بقرار إنشاء كل منها، بممارسة الاختصاصات الآتية:أ- تقييم نتائج البحوث الإكلينيكية وما قبل الإكلينيكية.
ب- المراجعة العلمية للمستحضر الدوائى أو البيولوجى، التى تسبق المراجعة الأولية من اللجنة المؤسسية المختصة، وذلك قبل البدء فى إجراء البحوث الطبية الإكلينيكية.
ج- تقييم المخطط البحثى والتعديلات التى ترد عليه، ومراجعة المستندات الخاصة بالمستحضر محل البحث الطبى، وذلك بقصد التأكد من تحقيق الممارسة الطبية الجيدة للتصنيع والتداول والحفظ.
د- التفتيش ، بغرض التحقق من الممارسة الطبية الجيدة، على الجهات البحثية التى يُجرى بها البحث الطبى والجهات ذات الصلة.
يستحق للجهات القومية الرقابية مقابل خدمة عن الخدمات المُشار إليها بالبنود السابقة بما لا يُجاوز ثلاثين ألف جنيه لكل بحث ممول، وتحدد فئات هذا المقابل بقرار من الوزير المختص بالصحة، ويحصل هذا المقابل بإيداعه خزينة الجهة الإدارية بموجب إيصال، على أن يودع فى بند مستقل بحساب هذه الهيئات لدى حساب الخزانة العامة الموحد.
وتحدد اللائحة التنفيذية الإجراءات التى تكفل قيام هذه الهيئات بممارسة هذه الاختصاصات، والتنسيق بينها وبين كل من اللجان المؤسسية المختصة والمجلس الأعلى فى هذا الشأن.
الفصل الخامس "مراحل الأبحاث الطبية الإكلينيكية وحالات استخدام الغفل (البلاسيبو)"
المــادة (12)
يتعين أن تسبق البحوث الطبية الإكلينيكية، بحوث طبية ما قبل إكلينيكية، تمت مراجعتها علميا وأخذت موافقة كتابية عليها من الهيئات القومية الرقابية.وتقسم البحوث الطبية الإكلينيكية إلى أربع مراحل، على النحو الآتى:
المرحلة الأولى:
مرحلة التجارب الأولى على البشر وفيها يتم اختيار مجموعة من المبحوثين (أصحاء أو مرضى) يتراوح عددهم بين عشرين وثمانين مبحوثا، يجرى تقسيمهم إلى مجموعات صغيرة، شريطة أن يكون الانتقال من مجموعة إلى أخرى بعد التأكد من أمان نتائج التدخل الطبى على المجموعة التى تسبقها، وتهدف هذه المرحلة للتأكد من أمان التدخل الطبى.
المرحلة الثانية:
المرحلة التى يجرى فيها البحث الطبى الإكلينيكى على مجموعة أكبر من المبحوثين، يتراوح عددهم بين مائتين وثلاثمائة مبحوث ممن يعانون من المرض المستهدف من البحث، وتهدف هذه المرحلة للمساعدة فى معرفة كيفية عمل التدخل الطبى، واستكمال ما تم بحثه فى المرحلة الأولى من أمان التدخل الطبى فى مجموعات أكبر من المرضى.
المرحلة الثالثة:
المرحلة التى يجرى فيها البحث الطبى الإكلينيكى على مجموعة من المبحوثين (المرضى) يتراوح عددهم بين مئات وآلاف، وتهدف هذه المرحلة لمعرفة مدى فاعلية التدخل الطبى مقارنة بأفضل العلاجات المتاحة.
المرحلة الرابعة:
تعرف بمرحلة ما بعد التسويق، وتتضمن المراقبة الآمنة المستمرة للدواء بعد حصوله على ترخيص التداول، وتـتم المـرحلتان الأولى والثانيـة فقـط علـى التدخلات الطبية التى تنشأ فـى مصـر، أما التدخلات الطبية التى تنشأ خارج مصر، فيُسمح بـــإجراء المرحلتين الثالثة والرابعة، بعد مراجعة واعتماد نتائج المرحلتين الأولى والثانيـة اللتين تـم إجراؤهما فى بلد المنشأ مـن الهيئـات القومية الرقابية والمجلـس الأعلى، ويستثنى مـن ذلــك التدخلات الطبيــة الخاصــة بالأمراض الإقليمية غيــر الموجودة فى بلــد منشــأ التدخل الطبى والأمراض النادرة، إذ يُسمح بإجراء البحوث الطبية بشأن أى منهــا داخــل مصر، بدايــة مــن المرحلــة الثانيــة، وبحســب مــا يقــره المجلس الأعلى.
المــادة (13)
استخدام مستحضر الغفل (البلاسيبو) ... يجوز استخدام مستحضر الغفل فى الحالتين الآتينين:1- المقارنة مع التدخل الجديد، لعدم وجود علاج متداول متاح ثبتت فاعليته.
2- المقارنة مع استخدام العلاج القياسي والتدخل الجديد.
ويشترط في الحالتين السابقتين أن استخدام العلاج الغفل لن يزيد الخطورة على المبحوث أو يلحق به أية أضرار ، وأنه لن يترتب على استخدامه حرمان المبحوث من العلاج القياسي.
وذلك كله على النحو الذي تبينه اللائحة التنفيذية.
1- الحق في الانسحاب من البحث الطبي وقتما يشاء ودون إلزامه بإبداء أية أسباب لذلك على أن يقوم الباحث الرئيسي بتبصرته بالأضرار الطبية الناجمة عن انسحابه.
2- عدم الإفصاح عن هويته أو أي بيان من بياناته، إلا بعد توافر شروط المبرر العلمي الذي تقره اللجنة المؤسسية المختصة، ويعتمده المجلس األعلى، وبموافقة كتابية من المبحوث أو ممثله القانوني.
3- الحصول على نسخة من الموافقة المستنيرة.
ويستثني من طلب موافقة المبحوث في هذه الحالة، الحالات التي يتطلبها التطبيق السليم للبحث الطبي والموضحة بالقوانين واللوائح المصرية المنظمة لتداول البيانات وسريتها، ولا يخل ذلك بسلطة المحكمة وجهات التحقيق المختصة في طلب الكشف عن هذه البيانات لضرورة تقتضيها إجراءات التحقيق أو المحاكمة.
وذلك كله على النحو المبين تفصيلا باللائحة التنفيذية لهذا القانون.
ويستثنى مما سبق، ما يمنح للمبحوث من مقابل تبعات الاشتراك في البحث الطبي، كمصاريف الانتقال من وإلى الجهة البحثية أو التغيب عن ساعات العمل التي يقتضيها البحث الطبي، على أن يحدد ذلك مسبقا- بشفافية تامة- في استمارة الموافقة المستنيرة المقدمة للجنة المؤسسية المختصة وموافقتها عليها.
وذلك كله على النحو الذي تبينه اللائحة التنفيذية.
يلتزم كل من الباحث الرئيسي وراعي الدراسة- إن وجد- بما يأتي:
1- تسجيل وحفظ جميع المعلومات والبيانات والتقارير المتعلقة بالبحث الطبي والتحقق من صحتها ودقتها.
2- إتاحة- أثناء وبعد انتهاء البحث الطبي- جميع المعلومات والبيانات والتقارير المتعلقة بالبحث الطبي، وذلك لكل من اللجنة المؤسسية المختصة والمجلس الأعلى والجهات القومية الرقابية والجهات المعنية، بغرض التدقيق والمراجعة.
3- عدم النشر أو الإعلان في الصحف أو وسائل الإعلام، عن أية معلومات أو بيانات أو تقارير عن البحث الطبي إلا بعد انتهائه والحصول- بغرض ذلك- على موافقة كتابية من اللجنة المؤسسية المختصة والمجلس الأعلى والموافقة الكتابية من المبحوثين المشاركين في حالة الإفصاح عن أى بيان أو معلومة متعلقة بهم.
1- أن يكون مستوفيا لكافة المؤهلات العلمية من دراسة وتدريب وخبره تمكنه من تولى مسئولية إدارة البحث الطبي وملما بقواعد وأخلاقيات البحث العلمي والتعامل مع المرضى.
2- أن يكون محمود السيرة حسن السمعة.
3- ألا يكون قد سبق الحكم عليه بعقوبة جناية أو بعقوبة مقيدة للحرية في جريمة مخلة بالشرف أو بالأمانة ما لم يكن قد رد إليه اعتباره.
4- ألا تتعارض مصلحته الشخصية في إجراء البحث أو استكماله مع مصلحة أو سلامة أي من المبحوثين المشاركين.
وذلك كله على النحو الذي تبينه اللائحة التنفيذية.
1- الحصول على الموافقات المطلوبة لإجراء البحث الطبي، من اللجنة المؤسسية والهيئات القومية الرقابية والمجلس الأعلى كل فيما يخصه.
2- الحصول على الموافقة المستنيرة من المبحوث المشارك أو من الممثل القانوني له وتوثيقها عن طريق الاستمارة المعدة لذلك والموقعة والمؤرخة من المبحوث والتي تمت مراجعتها والموافقة عليها من اللجنة المؤسسية.
3- الحصول على موافقة اللجنة المؤسسية المختصة، على بروتوكول البحث الطبي، واعتماد هذه الموافقة من المجلس الأعلى.
4- تسجيل المخطط البحثي (البروتوكول) في قاعدة بيانات الوزارة المختصة بالصحة.
5- الحصول على الموافقات الأخرى المطلوبة والموضحة بأحكام هذا القانون.
6- أن يختار الباحث الرئيسي المساعد والفريق البحثي المعاون له وفقا لمعايير الكفاءة العلمية.
7- أن يختار المبحوثين بتجرد تام، ويحدد العدد المناسب لإجراء البحث الطبي وفقا للبروتوكول المعتمد من المجلس الأعلى.
وذلك كله على النحو الذي تحدده اللائحة التنفيذية لهذا القانون.
1- الالتزام بإجراء البحث الطبي في الجهة البحثية والحضور والإشراف عليه بصفة منتظمة، وذلك وفقا للمتعارف عليه في هذا المجال.
2- أن يلتزم بالقوانين واللوائح المصرية ذات الصلة وأن يطبق مبادئ الممارسة الطبية الجيدة، وكذا المعايير المحلية والعالمية المتفق عليها في هذا الشأن.
3- أن يدير البحث الطبي طبقا للمخطط البحثي (البروتوكول) الحاصل على موافقة كل من اللجنة المؤسسية المختصة والهيئات القومية الرقابية، والمعتمد من المجلس الأعلى.
4- ألا يجرى أية تعديلات على ما ورد بالمخطط البحثي (البروتوكول)، إلا بعد الحصول على موافقة اللجنة المؤسسية المختصة، والهيئات القومية الرقابية- كل فيما يخصه- واعتمادها من المجلس الأعلى.
5- إحاطة المبحوث علما بأية تعديلات ستجرى على المخطط البحثي قد يكون من شأنها التأثير على سلامته، وكذلك إحاطته علما بأي مخاطر غير متوقعة قد تحدث له أثناء إجراء البحث الطبي أو لغيره من المبحوثين المشاركين.
6- اتخاذ التدابير اللازمة التي تستهدف حماية حياة المبحوث وصحته البدنية والنفسية وكرامته وكذا الحد من الآثار الجانبية للبحث الطبي والتي من ضمنها إدخال تعديلات على المخطط البحثي، حال حدوث آثار جانبية خطيرة تهدد سلامة المبحوث ويتعين في هذه الحالة على الباحث الرئيسي إبلاغ راعي البحث الطبي واللجنة المؤسسية والهيئات القومية الرقابية والمجلس الأعلى كل فيما يخصه بحدوث هذه الآثار والإجراءات التي قام بها لحماية المبحوث ، وذلك خلال 24 ساعة على الأكثر.
7- الحفاظ على المستندات الخاصة بالبحث الطبي بالجهة التي تجرى بها، ولدى راعي البحث الطبي- إن وجد- واتخاذ الإجراءات الكفيلة بمنع فقد أو إتلاف هذه المستندات.
8- الالتزام بنشر نتيجة البحث الطبي في إحدى المجلات العلمية المتخصصة وذلك عقب الانتهاء منها.
9- توفير – بعد انتهاء البحث الطبي بحسب كل حالة – الرعاية الطبية اللازمة للمبحوثين المشاركين متى تبين له حدوث آثار جانبية أو آثار جانبية خطيرة مرتبطة بها وعلى أن يقوم بإبلاغ المبحوثين المشاركين بحاجتهم لهذه الرعاية، وذلك كله بهدف الحد من أضرار هذه الآثار عليهم.
وذلك كله على النحو الذي تحدده اللائحة التنفيذية لهذا القانون.
1- الحصول على جميع الموافقات المطلوبة منه بحسب طبيعة ونوع البحث الطبى.
2- الإشراف على تنفيذ البحث الطبي وتمويله منذ بدئه حتى انتهائه.
3- وضع آليات مراقبة الأداء وجودته وضمان استخلاص نتائج البحث الطبي وتوثيقها وإعلانها، وذلك كله وفقا لبروتوكول الدراسة المعتمد من المجلس الأعلى، وطبقا للمارسة الطبية الجيدة.
4- تقديم تقارير دورية لكل من اللجنة المؤسسية المختصة، وكذا المجلس الأعلى عن كيفية سير البحث الطبي وتمويله.
5- تحرير الاتفاقات التي يعقدها مع جميع أطراف البحث الطبي على أن يدرجها ضمن من ملف البحث الطبي.
6- الاحتفاظ لديه ولدى قاعدة البيانات الخاصة البحوث الطبية بالمجلس الأعلى داخل جمهورية مصر العربية، بجميع الوثائق الرئيسية والبيانات الخاصة المتعلقة بالبحث الطبي، وذلك بعد نشر نتائجها.
7- توفير التدخل الطبي للمبحوثين المشاركين – أثناء وبعد إنتهاء البحث الطبي وبحسب كل حالة – بأي صورة كانت عليه، وكذا نقله وحفظه وتخزينه بالطرق الآمنة المناسبة.
8- الإبلاغ الفوري للمبحوثين المشاركين في البحث الطبي، على وجه السرعة، بأية تعديلات تجرى عليهم وبأية نتائج يمكن أن تؤثر بالسلب على سلامة المبحوثين المشاركين، وكذا بالآثار الجانبية الخطيرة غير المتوقعة للبحث الطبي.
9- الالتزام بإبرام عقد تأمين للمبحوثين المشاركين بالبحث الطبي، لدى إحدى شركات التأمين المعتمدة في جمهورية مصر العربية، بغرض مواجهة ما قد يصيب أى منهم من أضرار قد تنجم عن المشاركة في البحث الطبي.
10- ويتعين أن يكون العقد المشار إليه في الفقرة الأولى شاملا مدة البحث الطبي ومدة متابعته وبحيث يسرى لمدة عام تالى للانتهاء من البحث الطبي، وعلى أن تعتمد قيمة هذا التأمين من المجلس الأعلى.
11- التعويض والعلاج اللازمين للمبحوثين المشاركين في حالة الإصابة ذات الصلة بالبحث الطبي.
12- استكمال العلاج لمن يثبت حاجته لذلك من المبحوثين المشاركين حتى بعد انتهاء البحث الطبي.
وذلك كله على النحو الذي تحدده اللائحة التنفيذية لهذا القانون.
كما يلتزم كل من الباحث الرئيسي وراعى الدراسة بإخطار المبحوثين المشاركين وباقي الأطراف المشار إليها في الفقرة السابقة كتابيا هذه الإجراءات.
ولأي من هذه الأطراف التظلم من القرار الصادر من المجلس الأعلى في هذا الشأن وذلك كله على النحو الذي تبينه اللائحة التنفيذية.
1- استخدامها دون الحصول قبلا على الموافقة المستنيرة من المبحوث أو ممثله القانوني ودون إخلال بأحكام القوانين ذات الصلة.
2- تخزينها أو المواد الفائضة منها بعد الانتهاء من البحث الطبي، لغرض استخدامها في بحوث على الموافقة المستنيرة من المبحوث أو مستقبلية، أو إلي غرض آخر دون الحصول مسبقا ممثله القانوني وموافقة المجلس الأعلى.
3- الإتجار – على بأي صورة كانت – بأية عينات بشرية تم أخذها بغرض استخدامها في البحوث الطبية.
4- خروج أية عينات بشرية تخص البحوث الطبية من جمهورية مصر العربية، لأي غرضويستثنى من ذلك حالة الضرورة التي يصدر بها قرار بالموافقة من المجلس الأعلى بعد استطلاع رأى جهاز المخابرات العامة.
وذلك كله على النحو الموضح الذي تبينه اللائحة التنفيذية.
1- أن تكون مجهزة ومزودة بكافة الوسائل والأجهزة التي تمكن – بكفاءة – من إجراء البحث الطبي، بحسب طبيعته.
2- أن تكون على استعداد تام للتعامل مع حاالت الطوارئ، أو بحسب ما تقتضيه طبيعة البحث الطبي.
3- أن تتعامل مع معمل تحاليل مرخص ومعتمد من الوزارة المختصة بالصحة.
4- أن تكون مزودة بالوسائل والتجهيزات اللازمة لحفظ وتخزين كل ما يتعلق بالتدخل الطبي وفقا لطبيعته.
5- أن تكون مزودة بالأجهزة والوسائل اللازمة لحفظ البيانات والسجلات المتعلقة بالبحث الطبي.
6- أن يتسم أعضاء الفريق الطبي ومن يعاونه بالكفاءة والخبرة والشفافية والحيادية اللازمة لإجراء البحث الطبي، وكذا الدراية الكاملة بمعايير الممارسة الطبية الجيدة.
وفى كل الأحوال لا يصرح بإجراء الأبحاث الطبية إلا في الجهات البحثية المسجلة بالوزارة المختصة بالصحة ولا يصرح كذلك بإجرائها بالعيادات الخاصة.
وذلك كله على النحو الذي تبينه اللائحة التنفيذية.
فإذا ترتب على ذلك حدوث عاهة مستديمة، تكون العقوبة السجن المشدد وغرامة لا تقل عن مائة ألف جنيه ولا تزيد على خمسمائة ألف جنيه، وتكون العقوبة السجن المشدد الذي لا تقل مدته عن عشر سنين وغرامة لا تقل عن خمسمائة ألف جنيه ولا تزيد على مليون جنيه إذا ترتب على الفعل المشار إليه موت شخص أو أكثر.
فإذا ترتب على وقوع الجريمة المشار إليها في الفقرة السابقة، آثار جانبية على المبحوث فيضاعف الحدين الأدنى والأقصى المقررين في الفقرة السابقة، أما إذا نشأ عن ذلك آثار جانبية خطيرة على المبحوث فتكون العقوبة الحبس والغرامة التي لا تقل عن مائة ألف جنيه ولا تزيد على خمسمائة ألف جنيه أو بإحدى هاتين العقوبتين.
ويكون الشخص الاعتباري مسئولا بالتضامن عن الوفاء بما يحكم به من عقوبات مالية وتعويضات.
الفصل السادس "حقوق المبحوثين"
المــادة (14)
يتمتع المبحوث بالحقوق الآتية:1- الحق في الانسحاب من البحث الطبي وقتما يشاء ودون إلزامه بإبداء أية أسباب لذلك على أن يقوم الباحث الرئيسي بتبصرته بالأضرار الطبية الناجمة عن انسحابه.
2- عدم الإفصاح عن هويته أو أي بيان من بياناته، إلا بعد توافر شروط المبرر العلمي الذي تقره اللجنة المؤسسية المختصة، ويعتمده المجلس األعلى، وبموافقة كتابية من المبحوث أو ممثله القانوني.
3- الحصول على نسخة من الموافقة المستنيرة.
ويستثني من طلب موافقة المبحوث في هذه الحالة، الحالات التي يتطلبها التطبيق السليم للبحث الطبي والموضحة بالقوانين واللوائح المصرية المنظمة لتداول البيانات وسريتها، ولا يخل ذلك بسلطة المحكمة وجهات التحقيق المختصة في طلب الكشف عن هذه البيانات لضرورة تقتضيها إجراءات التحقيق أو المحاكمة.
وذلك كله على النحو المبين تفصيلا باللائحة التنفيذية لهذا القانون.
المــادة (15)
يحظر إشراك المبحوث في أى بحث طبي آخر، قبل انتهاء الفترة المحددة ببروتوكول المخطط البحثي السابق اشتراكه فيه.المــادة (16)
يحظر تحفيز المبحوث للاشتراك في أي بحث طبي، وذلك بمنحه مكافآت أو مزايا نقدية أو عينية.ويستثنى مما سبق، ما يمنح للمبحوث من مقابل تبعات الاشتراك في البحث الطبي، كمصاريف الانتقال من وإلى الجهة البحثية أو التغيب عن ساعات العمل التي يقتضيها البحث الطبي، على أن يحدد ذلك مسبقا- بشفافية تامة- في استمارة الموافقة المستنيرة المقدمة للجنة المؤسسية المختصة وموافقتها عليها.
وذلك كله على النحو الذي تبينه اللائحة التنفيذية.
المــادة (17)
التعامل مع بيانات المبحوثين والمحافظة على سريتها.يلتزم كل من الباحث الرئيسي وراعي الدراسة- إن وجد- بما يأتي:
1- تسجيل وحفظ جميع المعلومات والبيانات والتقارير المتعلقة بالبحث الطبي والتحقق من صحتها ودقتها.
2- إتاحة- أثناء وبعد انتهاء البحث الطبي- جميع المعلومات والبيانات والتقارير المتعلقة بالبحث الطبي، وذلك لكل من اللجنة المؤسسية المختصة والمجلس الأعلى والجهات القومية الرقابية والجهات المعنية، بغرض التدقيق والمراجعة.
3- عدم النشر أو الإعلان في الصحف أو وسائل الإعلام، عن أية معلومات أو بيانات أو تقارير عن البحث الطبي إلا بعد انتهائه والحصول- بغرض ذلك- على موافقة كتابية من اللجنة المؤسسية المختصة والمجلس الأعلى والموافقة الكتابية من المبحوثين المشاركين في حالة الإفصاح عن أى بيان أو معلومة متعلقة بهم.
الفصل السابع "الشروط والإجراءات والالتزامات المللقاه على الباحث الرئيسي"
المــادة (18)
يشترط في الباحث الرئيسي قبل البدء فى إجراء البحث الطبى، أن يتخذ الإجراءات الآتية:1- أن يكون مستوفيا لكافة المؤهلات العلمية من دراسة وتدريب وخبره تمكنه من تولى مسئولية إدارة البحث الطبي وملما بقواعد وأخلاقيات البحث العلمي والتعامل مع المرضى.
2- أن يكون محمود السيرة حسن السمعة.
3- ألا يكون قد سبق الحكم عليه بعقوبة جناية أو بعقوبة مقيدة للحرية في جريمة مخلة بالشرف أو بالأمانة ما لم يكن قد رد إليه اعتباره.
4- ألا تتعارض مصلحته الشخصية في إجراء البحث أو استكماله مع مصلحة أو سلامة أي من المبحوثين المشاركين.
وذلك كله على النحو الذي تبينه اللائحة التنفيذية.
المــادة (19)
يلتزم الباحث الرئيسي قبل البدء في إجراء البحث الطبي، أن يتخذ الإجراءات الآتية:1- الحصول على الموافقات المطلوبة لإجراء البحث الطبي، من اللجنة المؤسسية والهيئات القومية الرقابية والمجلس الأعلى كل فيما يخصه.
2- الحصول على الموافقة المستنيرة من المبحوث المشارك أو من الممثل القانوني له وتوثيقها عن طريق الاستمارة المعدة لذلك والموقعة والمؤرخة من المبحوث والتي تمت مراجعتها والموافقة عليها من اللجنة المؤسسية.
3- الحصول على موافقة اللجنة المؤسسية المختصة، على بروتوكول البحث الطبي، واعتماد هذه الموافقة من المجلس الأعلى.
4- تسجيل المخطط البحثي (البروتوكول) في قاعدة بيانات الوزارة المختصة بالصحة.
5- الحصول على الموافقات الأخرى المطلوبة والموضحة بأحكام هذا القانون.
6- أن يختار الباحث الرئيسي المساعد والفريق البحثي المعاون له وفقا لمعايير الكفاءة العلمية.
7- أن يختار المبحوثين بتجرد تام، ويحدد العدد المناسب لإجراء البحث الطبي وفقا للبروتوكول المعتمد من المجلس الأعلى.
وذلك كله على النحو الذي تحدده اللائحة التنفيذية لهذا القانون.
المــادة (20)
يتعين على الباحث الرئيسي أثناء إجراء البحث الطبي الالتزام بما يلي:1- الالتزام بإجراء البحث الطبي في الجهة البحثية والحضور والإشراف عليه بصفة منتظمة، وذلك وفقا للمتعارف عليه في هذا المجال.
2- أن يلتزم بالقوانين واللوائح المصرية ذات الصلة وأن يطبق مبادئ الممارسة الطبية الجيدة، وكذا المعايير المحلية والعالمية المتفق عليها في هذا الشأن.
3- أن يدير البحث الطبي طبقا للمخطط البحثي (البروتوكول) الحاصل على موافقة كل من اللجنة المؤسسية المختصة والهيئات القومية الرقابية، والمعتمد من المجلس الأعلى.
4- ألا يجرى أية تعديلات على ما ورد بالمخطط البحثي (البروتوكول)، إلا بعد الحصول على موافقة اللجنة المؤسسية المختصة، والهيئات القومية الرقابية- كل فيما يخصه- واعتمادها من المجلس الأعلى.
5- إحاطة المبحوث علما بأية تعديلات ستجرى على المخطط البحثي قد يكون من شأنها التأثير على سلامته، وكذلك إحاطته علما بأي مخاطر غير متوقعة قد تحدث له أثناء إجراء البحث الطبي أو لغيره من المبحوثين المشاركين.
6- اتخاذ التدابير اللازمة التي تستهدف حماية حياة المبحوث وصحته البدنية والنفسية وكرامته وكذا الحد من الآثار الجانبية للبحث الطبي والتي من ضمنها إدخال تعديلات على المخطط البحثي، حال حدوث آثار جانبية خطيرة تهدد سلامة المبحوث ويتعين في هذه الحالة على الباحث الرئيسي إبلاغ راعي البحث الطبي واللجنة المؤسسية والهيئات القومية الرقابية والمجلس الأعلى كل فيما يخصه بحدوث هذه الآثار والإجراءات التي قام بها لحماية المبحوث ، وذلك خلال 24 ساعة على الأكثر.
7- الحفاظ على المستندات الخاصة بالبحث الطبي بالجهة التي تجرى بها، ولدى راعي البحث الطبي- إن وجد- واتخاذ الإجراءات الكفيلة بمنع فقد أو إتلاف هذه المستندات.
8- الالتزام بنشر نتيجة البحث الطبي في إحدى المجلات العلمية المتخصصة وذلك عقب الانتهاء منها.
9- توفير – بعد انتهاء البحث الطبي بحسب كل حالة – الرعاية الطبية اللازمة للمبحوثين المشاركين متى تبين له حدوث آثار جانبية أو آثار جانبية خطيرة مرتبطة بها وعلى أن يقوم بإبلاغ المبحوثين المشاركين بحاجتهم لهذه الرعاية، وذلك كله بهدف الحد من أضرار هذه الآثار عليهم.
وذلك كله على النحو الذي تحدده اللائحة التنفيذية لهذا القانون.
المــادة (21)
يتولى الباحث الرئيسي كافة مهام وواجبات الدراسة البحثية الطبية وتمويلها في حالة عدم وجود راع لها.الفصل الثامن "التزامات راعي البحث الطبي"
المــادة (22)
يلتزم راعي البحث الطبي بالقيام بما يلي:1- الحصول على جميع الموافقات المطلوبة منه بحسب طبيعة ونوع البحث الطبى.
2- الإشراف على تنفيذ البحث الطبي وتمويله منذ بدئه حتى انتهائه.
3- وضع آليات مراقبة الأداء وجودته وضمان استخلاص نتائج البحث الطبي وتوثيقها وإعلانها، وذلك كله وفقا لبروتوكول الدراسة المعتمد من المجلس الأعلى، وطبقا للمارسة الطبية الجيدة.
4- تقديم تقارير دورية لكل من اللجنة المؤسسية المختصة، وكذا المجلس الأعلى عن كيفية سير البحث الطبي وتمويله.
5- تحرير الاتفاقات التي يعقدها مع جميع أطراف البحث الطبي على أن يدرجها ضمن من ملف البحث الطبي.
6- الاحتفاظ لديه ولدى قاعدة البيانات الخاصة البحوث الطبية بالمجلس الأعلى داخل جمهورية مصر العربية، بجميع الوثائق الرئيسية والبيانات الخاصة المتعلقة بالبحث الطبي، وذلك بعد نشر نتائجها.
7- توفير التدخل الطبي للمبحوثين المشاركين – أثناء وبعد إنتهاء البحث الطبي وبحسب كل حالة – بأي صورة كانت عليه، وكذا نقله وحفظه وتخزينه بالطرق الآمنة المناسبة.
8- الإبلاغ الفوري للمبحوثين المشاركين في البحث الطبي، على وجه السرعة، بأية تعديلات تجرى عليهم وبأية نتائج يمكن أن تؤثر بالسلب على سلامة المبحوثين المشاركين، وكذا بالآثار الجانبية الخطيرة غير المتوقعة للبحث الطبي.
9- الالتزام بإبرام عقد تأمين للمبحوثين المشاركين بالبحث الطبي، لدى إحدى شركات التأمين المعتمدة في جمهورية مصر العربية، بغرض مواجهة ما قد يصيب أى منهم من أضرار قد تنجم عن المشاركة في البحث الطبي.
10- ويتعين أن يكون العقد المشار إليه في الفقرة الأولى شاملا مدة البحث الطبي ومدة متابعته وبحيث يسرى لمدة عام تالى للانتهاء من البحث الطبي، وعلى أن تعتمد قيمة هذا التأمين من المجلس الأعلى.
11- التعويض والعلاج اللازمين للمبحوثين المشاركين في حالة الإصابة ذات الصلة بالبحث الطبي.
12- استكمال العلاج لمن يثبت حاجته لذلك من المبحوثين المشاركين حتى بعد انتهاء البحث الطبي.
وذلك كله على النحو الذي تحدده اللائحة التنفيذية لهذا القانون.
المــادة (23)
يجوز لراعى البحث الطبي أن يستعين بأي من المختصين في مجال البحوث الطبية أو يوكل إحدى منظمات البحوث الطبية التعاقدية، وذلك لأداء واحد أو أكثر من التزامات أو مهام البحث الطبي المنوطة به، وذلك على النحو المبين باللائحة التنفيذية.الفصل التاسع "التعليق والإنهاء المبكر للبحوث الطبية"
المــادة (24)
يتعين على كل من الباحث الرئيسي وراعى البحث والجهة البحثية واللجنة المؤسسية المختصة والهيئات القومية الرقابية حال تعرض المبحوث لآثار جانبية أو آثار جانبية خطيرة أو أضرار لم تكن متوقعة وقت الموافقة على البروتوكول أو لممارسة طبية غير جيدة، أن يقوم – كل فيما يخصه – باتخاذ الإجراءات التي من شأنها تعليق أو إنهاء البحث بحسب كل حالة على أن يقوم متخذ هذه الإجراءات بالإخطار الكتابي الفوري بها للمجلس الأعلى ليصدر بدوره ما يلزم من قرارات بشأنها .كما يلتزم كل من الباحث الرئيسي وراعى الدراسة بإخطار المبحوثين المشاركين وباقي الأطراف المشار إليها في الفقرة السابقة كتابيا هذه الإجراءات.
ولأي من هذه الأطراف التظلم من القرار الصادر من المجلس الأعلى في هذا الشأن وذلك كله على النحو الذي تبينه اللائحة التنفيذية.
الفصل العاشر "أحكام استخدام العينات البشرية الخاصة بالبحوث الطبية"
المــادة (25)
يحظر في حالة استخدام العينات البشرية الخاصة بالبحوث الطبية إتيان الأفعال الآتية:1- استخدامها دون الحصول قبلا على الموافقة المستنيرة من المبحوث أو ممثله القانوني ودون إخلال بأحكام القوانين ذات الصلة.
2- تخزينها أو المواد الفائضة منها بعد الانتهاء من البحث الطبي، لغرض استخدامها في بحوث على الموافقة المستنيرة من المبحوث أو مستقبلية، أو إلي غرض آخر دون الحصول مسبقا ممثله القانوني وموافقة المجلس الأعلى.
3- الإتجار – على بأي صورة كانت – بأية عينات بشرية تم أخذها بغرض استخدامها في البحوث الطبية.
4- خروج أية عينات بشرية تخص البحوث الطبية من جمهورية مصر العربية، لأي غرضويستثنى من ذلك حالة الضرورة التي يصدر بها قرار بالموافقة من المجلس الأعلى بعد استطلاع رأى جهاز المخابرات العامة.
وذلك كله على النحو الموضح الذي تبينه اللائحة التنفيذية.
الفصل الحادي عشر "اشتراطات الجهة البحثية"
المــادة (26)
يشترط في الجهة البحثية توافر الآتي:1- أن تكون مجهزة ومزودة بكافة الوسائل والأجهزة التي تمكن – بكفاءة – من إجراء البحث الطبي، بحسب طبيعته.
2- أن تكون على استعداد تام للتعامل مع حاالت الطوارئ، أو بحسب ما تقتضيه طبيعة البحث الطبي.
3- أن تتعامل مع معمل تحاليل مرخص ومعتمد من الوزارة المختصة بالصحة.
4- أن تكون مزودة بالوسائل والتجهيزات اللازمة لحفظ وتخزين كل ما يتعلق بالتدخل الطبي وفقا لطبيعته.
5- أن تكون مزودة بالأجهزة والوسائل اللازمة لحفظ البيانات والسجلات المتعلقة بالبحث الطبي.
6- أن يتسم أعضاء الفريق الطبي ومن يعاونه بالكفاءة والخبرة والشفافية والحيادية اللازمة لإجراء البحث الطبي، وكذا الدراية الكاملة بمعايير الممارسة الطبية الجيدة.
وفى كل الأحوال لا يصرح بإجراء الأبحاث الطبية إلا في الجهات البحثية المسجلة بالوزارة المختصة بالصحة ولا يصرح كذلك بإجرائها بالعيادات الخاصة.
وذلك كله على النحو الذي تبينه اللائحة التنفيذية.
الفصل الثاني عشر "المسئولية والعقوبات"
المــادة (27)
مع عدم الإخلال بأية عقوبة أشد منصوص عليها في قانون العقوبات أو أي قانون آخر يعاقب على ارتكاب كل من الجرائم المنصوص عليها في المواد التالية بالعقوبات المقررة لها.المــادة (28)
يعاقب بالسجن وبغرامة لا تقل عن خمسين ألف جنيه ولا تزيد على مائة ألف جنيه، كل من أجرى دون الحصول على الموافقة المستنيرة من المبحوث ومن الممثل القانونى عن الفئات المستحقة حماية إضافية من المبحوثين وموافقات الجهات المحددة بهذا القانون.فإذا ترتب على ذلك حدوث عاهة مستديمة، تكون العقوبة السجن المشدد وغرامة لا تقل عن مائة ألف جنيه ولا تزيد على خمسمائة ألف جنيه، وتكون العقوبة السجن المشدد الذي لا تقل مدته عن عشر سنين وغرامة لا تقل عن خمسمائة ألف جنيه ولا تزيد على مليون جنيه إذا ترتب على الفعل المشار إليه موت شخص أو أكثر.
المــادة (29)
يعاقب بالسجن وبغرامة لا تقل عن خمسين ألف جنيه ولا تزيد على خمسمائة ألف جنيه أو بإحدى هاتين العقوبتين، كل من الباحث الرئيسى وراعى الدراسة حال عدم الالتزام بأى حكم من أحكام المادتين (20، 22) من هذا القانون.المــادة (30)
يعاقب بغرامة لا تقل عن عشرة آلاف جنيه ولا تزيد على خمسين ألف جنيه كل من الباحث الرئيسي وراعي البحث حال عدم الالتزام بتقديم الرعاية الطبية اللازمة لأي من المبحوثين أثناء وبعد البحث الطبي.فإذا ترتب على وقوع الجريمة المشار إليها في الفقرة السابقة، آثار جانبية على المبحوث فيضاعف الحدين الأدنى والأقصى المقررين في الفقرة السابقة، أما إذا نشأ عن ذلك آثار جانبية خطيرة على المبحوث فتكون العقوبة الحبس والغرامة التي لا تقل عن مائة ألف جنيه ولا تزيد على خمسمائة ألف جنيه أو بإحدى هاتين العقوبتين.
المــادة (31)
يعاقب بغرامة لا تقل عن مائة ألف جنيه ولا تزيد على خمسمائة ألف جنيه، أي جهة بحثية أجرت بحثا طبيا إكلينيكيا دون توافر أي شرط من اشتراطات الجهة البحثية المنصوص عليها في هذا القانون، فإذا ترتب على ذلك آثار جانبية خطيرة للمبحوث، فتكون العقوبة الغرامة لا تقل عن خمسمائة ألف جنيه ولا تزيد على مليون جنيه.المــادة (32)
يعاقب بالسجن وبغرامة لا تقل عن خمسمائة ألف جنيه ولا تزيد على مليون جنيه أو بإحدى هاتين العقوبتين، كل من ساهم بأي صورة كانت على خروج عينات بشرية تستخدم في الأبحاث الطبية الإكلينيكية أثناء إجرائها أو بعد انتهائها دون الحصول مسبقا على الموافقات المتطلبة وفقا لأحكام القانون.المــادة (33)
يعاقب المسئول عن الإدارة الفعلية للشخص الاعتباري بذات العقوبات المقررة عن الأفعال التي ترتكب بالمخالفة لأحكام هذا القانون إذا ثبت علمه بها، وكان إخلاله بالواجبات التي تفرضها عليه تلك الإدارة قد أسهم في وقوع الجريمة.ويكون الشخص الاعتباري مسئولا بالتضامن عن الوفاء بما يحكم به من عقوبات مالية وتعويضات.
المــادة (34)
يكون للموظفين القائمين على تنفيذ هذا القانون والقرارات المنفذة له الذين يصدر بتحديدهم قرارا من وزير العدل بالاتفاق مع الوزير المختص بالصحة صفة مأموري الضبط القضائي بالنسبة للجرائم التي تقع بالمخالفة ألحكام هذا القانون.مصادر:



هل يمكنني ان أشارك هذه المقالات وانشرها وأضع عليها إسم موقعكم
ردحذفلاني ارى أن هذه المقالات مفيده جدا
ارجو الرد
بالطبع وبدون اسم الموقع عادى
حذف